药物杂质研究平台介绍
一、平台主旨
提高国内杂质供应水平及能力,为提升国内药品研发水平助力。
二、现状分析
2.1研究需求
FDA、欧盟、ICH对杂质的研究理念,均遵从了“质量源于设计”,要求对杂质进行科学性和系统性研究。我国在这方面的要求也在逐步提高。原来药物研究更多关注药典收载的杂质,每次药典版本更新都需要重新提升标准,如果在申报过程中药典标准发生了变化,相关工作都需要重新开展。
我们从起始原料的工艺路线(常规不少于3步)开始溯源,根据反应机理,把可能(不少于2级)产生的杂质都进行梳理,并依据ICH等指导原则,结合后续工艺,编写溯源文件,说明杂质来源、去向及控制方法,制定科学、合理的研究策略,并在此基础上制定符合产业化的质量标准。
目前这个思路和流程适用于所有的药物杂质研究。
2.2市场供应
以头孢杂质为例,法定杂质于药典匹配,数量较少,不足以满足现在的政策法规要求,需要自制或从杂质公司采购、定制,每套杂质从十几万到几十万不等,价格昂贵,且来源大多为国外公司,货期很难保证。
另外,现在可买到的杂质与自研工艺的匹配性未可知,科学性、系统性也需要评估。
三、服务内容
我们可以根据提供的工艺路线进行系统的杂质溯源,提供全套的杂质研究服务。
分类包括:有机杂质(包括基因毒性杂质)、无机元素杂质、残留溶剂。
对象包括:原料药的起始物料杂质、中间体杂质及成品杂质,制剂的
原料药杂质及制剂杂质;
内容包括:杂质溯源及控制策略资料(附案例,可直接用于申报),
杂质对照品制备、鉴定、赋值,有关物质方法开发及验证。
四、技术储备
从2005年至今十几年间,一直致力于化学药品开发与研究工作,已开发的数十个产品均有系统的杂质溯源,并自行制备了杂质对照品,目前储备的杂质对照品有数千个。该平台上合成人员均具有十几年的药物合成、杂质工艺研究经验,纯化团队由具有二十多年纯化设备应用及分离经验的专家带队,确证和赋值由合作多年有资质的第三方承担。方法开发及方法学验证由具有多年研发经验的药物分析人员负责。该平台同时纳入公司的CNAS质量管理体系,并设有项目管理和注册部,与项目部共同负责研究过程的技术管理,确保研究工作的规范性、科学性和及时性。
五、平台设备
目前,该平台拥有数十人的专业杂质制备人员队伍。研究设备包括平行合成反应仪,数十台HPLC、UPLC-PDA、UPLC-QDA、FLASH快速分离色谱,Waters自动纯化系统,冻干机,旋蒸仪,低温冰箱等分离及辅助设备。
六、工作流程
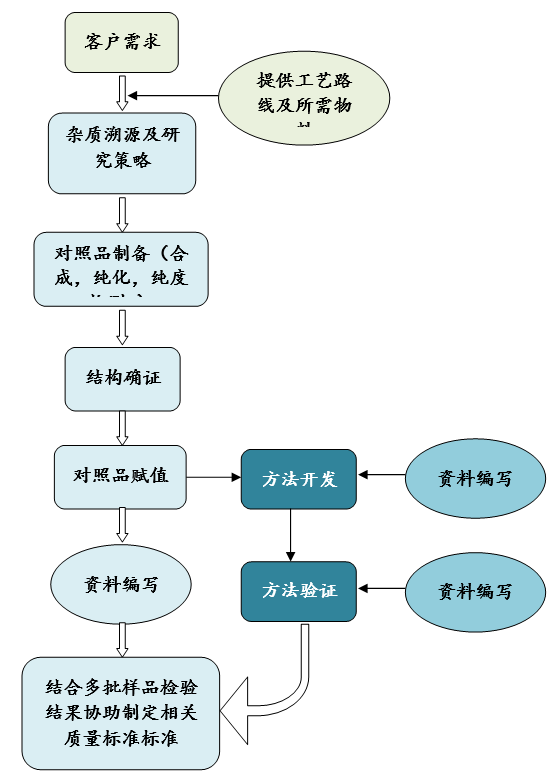
七、项目案例(杂质溯源、制备分离)
杂质溯源案例(仅以阿维巴坦原料药有关物质为例,未列举基毒,溶残、无机及元素杂质等)
工艺路线如下:
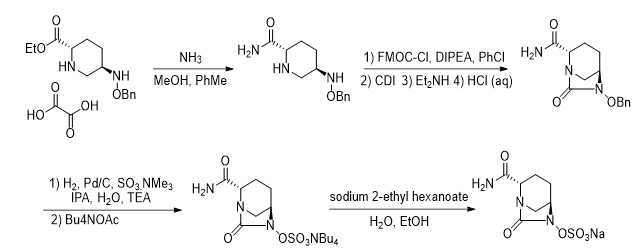
我们对工艺过程中的每步反应机理进行了分析,由此推测了可能存在的杂质及制定了杂质控制策略:
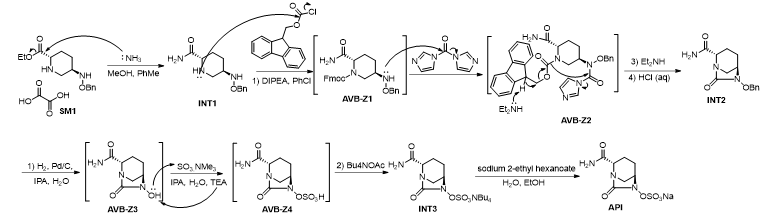
杂质控制策略
1)起始物料杂质控制
杂质代号 | 杂质结构 | 可能来源 | 是否定入标准 | 控制限度 |
SM1-Z1 | | 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z2 |
| 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z3 |
| 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z4 |
| 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z5 |
| 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z6 |
| 合成中间体 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z7 |
| 非对映异构体 | 是 | 按标准不大于0.2% |
SM1-Z8 |
| 非对映异构体 | 是 | 按标准不大于0.2% |
SM1-Z9 |
| 对映异构体 | 是 | 按标准不大于0.2% |
SM1-Z10 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.5% |
SM1-Z11 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于1% |
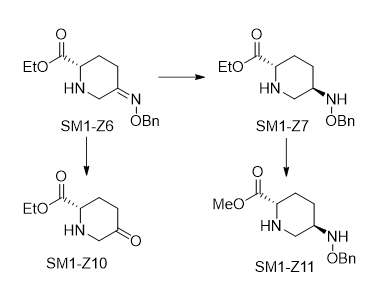
起始原料SM中的杂质分合成中间体杂质、立体异构体和工艺杂质。
杂质SM1-Z1至Z6均为SM1中的合成中间体,从化学结构上看SM1-Z1至Z5都不可能与草酸成盐,因此在重结晶过程中应很容易被除去,所以我们按一般杂质处理,设定限度小于0.5%。SM1-Z7能与草酸成盐,并可能在后续阿维巴坦钠合成工艺中参与反应,但后续不会成磺酸盐,很容易被除去,经多批次起始物料SM1检测SM1-Z6均未检出或含量小于0.1%,所以我们按一般杂质处理,设定限度小于0.5%。
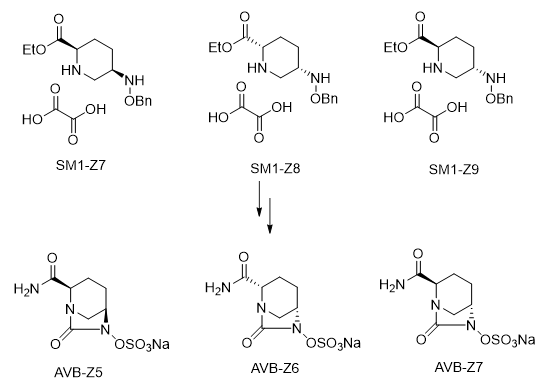
SM1的有立体异构体产生可能性,认为其3个立体异构体均由产生的可能,SM1-Z7、Z8和Z9,它们与SM1化学结构相似,会在阿维巴坦钠合成工艺中参与反应,生成原料药产品的立体异构体AVB-Z5、Z6和Z7。我们按标准控制SM3-Z7、SM3-Z8与SM3-Z9峰面积不大于0.2%,经多批次原料药检测AVBZ5、Z6和Z7均未检出或含量不大于0.1%。
2)中间体及API杂质控制
杂质代号 | 杂质结构 | 可能来源 | 是否定入标准 | 控制限度 |
SM1 |
| 起始物料 | 是 | 按标准不大于0.1% |
INT1 |
| 工艺中间体 | 是 | 按标准不大于0.1% |
INT2 |
| 工艺中间体 | 是 | 按标准不大于0.1% |
AVB-Z1 |
| 工艺中间体 | 是 | 按标准不大于0.1% |
AVB-Z2 |
| 工艺中间体 | 是 | 按标准不大于0.1% |
AVB-Z3 | | 工艺中间体降解杂货 | 是 | 按标准不大于0.1% |
AVB-Z4 |
| 工艺中间体 | 是 | 按一般杂质处理,不大于0.1% |
AVB-Z5 | | 非对映异构体 | 是 | 按标准不大于0.1% |
AVB-Z6 | | 非对映异构体 | 是 | 按标准不大于0.1% |
AVB-Z7 |
| 对映异构体 | 是 | 按标准不大于0.1% |
AVB-Z8 |
| 降解杂货 | 是 | 按标准不大于0.1% |
AVB-Z9 |
| 降解杂货 | 是 | 按标准不大于0.1% |
AVB-Z10 |
| 降解杂货 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z11 |
| 工艺杂质 | 是 | 按标准不大于0.1% |
AVB-Z12 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z13 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z14 | | 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z15 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z16 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z17 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z18 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z19 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z20 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z21 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z22 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z23 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z24 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z25 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z26 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z27 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z28 |
| 工艺杂质 | 否 | 按标准不大于0.1% |
AVB-Z29 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z30 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z31 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
AVB-Z32 |
| 工艺杂质 | 否 | 按一般杂质处理,不大于0.1% |
①立体异构体杂质来源分析:
根据对起始原料SM1的立体异构体分析,我们确定SM1可能存在两个非对映异构体SM1-Z7和Z8,以及一个对映异构体SM1-Z9,因此我们按照原料药工艺路线分析,阿维巴坦钠除去自身构型,可能存在3个立体异构体,即AVB-Z5、Z6和Z7:
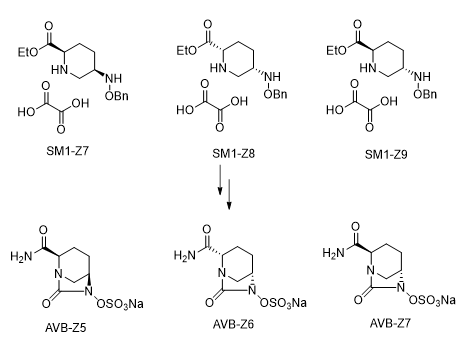
图3.2.S.3.2.2.4-1立体异构体生成途径
在我们的合成路线各步反应中,不存在手性翻转的条件,因此在不考虑降解途径的前提下,原料药的立体异构体均由起始原料中含有手性的SM1引入。AVB-Z5和Z6互为对映异构体,在非手性的反相液相色谱条件下出峰位置相同;TCG- Z7和API与其互为对映异构体,在非手性的反相色谱条件下出峰位置相同。在手性的正相色谱条件下API和其3个立体异构体出峰位置都不同。因此我们需要控制终成品在非手性的反相液相色谱条件下手性杂质AVB-Z5和Z6的总含量≤0.2%,在手性的正相色谱条件下AVB-Z5、Z6和Z7的含量均≤0.1%。
②降解杂质来源分析:
从阿维巴坦钠分子结构分析,其结构中含有桥环结构,稳定性较差的磺酸酯结构,以及脲的结构,因此我们分析了其在多种条件下可能生成的降解产物。
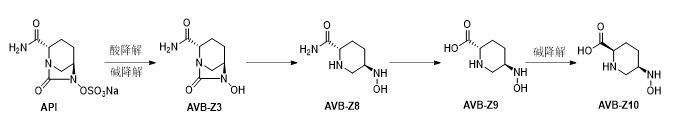
图3.2.S.3.2.2.4-1降解杂质的来源路径
阿维巴坦钠分子中元素大多在比较高的稳定价态,因此在光照和氧化条件下比较稳定。但其硫酸酯和脲的结构,在酸性和碱性条件下均会发生分解,逐步分解为杂质AVB-Z3、Z8、Z9,在强碱条件下, 具有α-氨基酸结构AVB-Z9可能会发生α位消旋化生成AVB-Z10。根据降解产物产生的可能性及最终产品的检测情况,我们对降解杂质进行了如下控制,杂质限度AVB-Z3、Z8、Z9,含量均不得大于0.1%;AVB-Z10为四级降解产物,在一至三级降解氧化产物限度不得大与0.1%的情况下,生成AVB-Z10可能性和可能含量都非常小,我们只对其进行几个批次的检测,不将其列入质量标准。
③工艺杂质来源分析:
阿维巴坦钠的合成工艺路线较长,虽然表观步骤是4步,实际上经历了8步反应,经历了多个不分离的中间体。从起始原料可能引入工艺杂质,中间体和终产物在反应过程中也可能发生副反应产生工艺杂质,因此我们分析了在工艺路线中可能生成的工艺杂质,见下图。
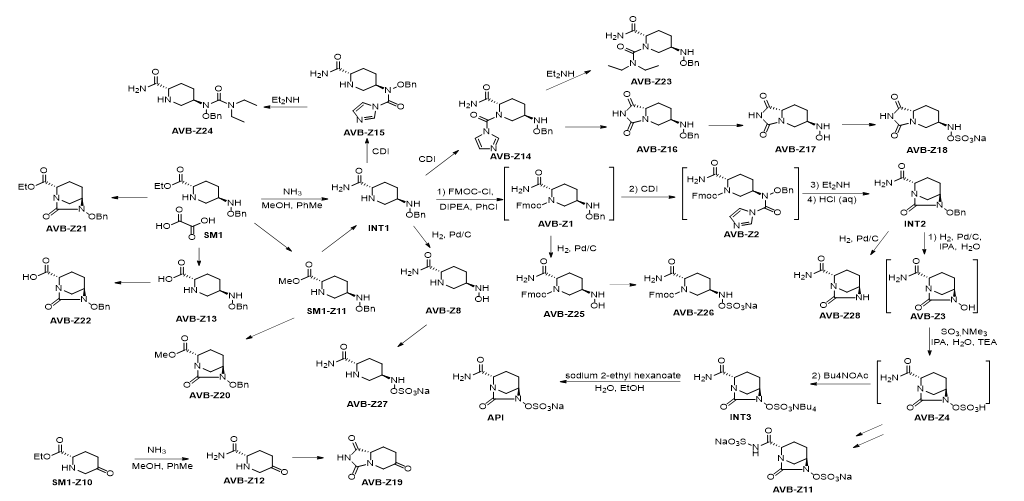
杂质AVB-Z1至Z28的来源路径
中间体INT1的杂质可能由起始物料SM1的杂质SM1-Z10带入,其可能发生氨解生成杂质AVB-Z12,并经阿维巴坦钠的合成工艺路线最终得到杂质AVB-Z19;SM1在氨解过程中可能发生酯交换或者水解反应,生成杂质SM1-Z11 和AVB-Z13。
中间体INT2由INT1经过连投的三部反应得到,所以可能残留未反应完全的中间体INT1、AVB-Z1和AVB-Z2。中间体INT1中残留的SM1、杂质SM1-Z11和 AVB-Z13都可能发生后续关环反应生成杂质AVB-Z21、AVB-Z20 和AVB-Z22。在反应过程中,可能会有未与FMOC-Cl反应的中间体INT1与随后加入的CDI反应,生成杂质AVB-Z14和Z15,它们与二乙胺反应,可以生成杂质AVB-Z23和Z24。杂质AVB-Z14还可能自身环合,生成并环化和物AVB-Z16。使用的保护试剂FMOC-Cl和关环试剂CDI,可能会有副产物残留,所以我们监控了其可能产生的杂质AVB-Z29、Z30、Z31和Z32。中间体INT3由INT2经过连投的三部反应得到,所以可能残留未反应完全的中间体INT2、AVB-Z3和AVB-Z4。前一步残留的中间体INT1、杂质AVB-Z1和 AVB-Z16都可能发生后续的氢化反应生成杂质AVB-Z8、Z25和Z17,并进一步形成硫酸盐AVB-Z27、Z26和Z18。在反应过程中,还可能会有过渡还原发生,得到羟胺断裂的产物AVB-Z28。并且酰胺基也存在形成硫酸盐的可能,生成杂质AVB-Z11。
我们之前已经分析和控制的降解杂质和立体异构体杂质中,有个别同样是工艺杂质,我们不再进行重复控制。我们对比较可能生成的工艺杂质都进行了研究定位,并进行了分步限度控制,尽量在中间体处控制工艺杂质,减少API处工艺杂质控制的难度,手性杂质在最后的API处控制,严格排除工艺过程中手性中心消旋的可能。